Mullistaako tekoäly elävien solujen kuvantamisen?

Kuvantamismenetelmät ovat tärkeitä sekä solutason ilmiöiden ymmärtämisessä että esimerkiksi lääketieteellisessä diagnostiikassa ja lääkekehityksessä. Tutkija selvitti, miten syväoppimista voidaan hyödyntää elävien solujen kuvantamisessa, jotta hahmottaisimme solujen maailmaa entistä paremmin.
Johdanto
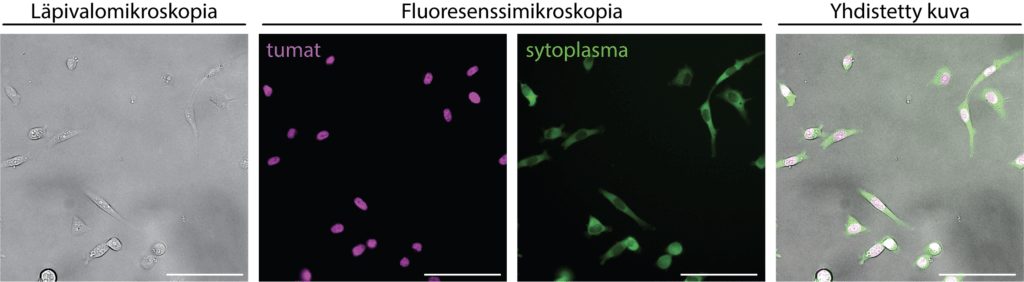
Miten voimme tutkia eläviä soluja, niiden liikkeitä ja solujen proteiinien ilmenemistä? Tällaisiin kysymyksiin elävien solujen mikroskooppi-kuvantamisella pyritään vastaamaan. Läpivalo- ja fluoresenssimikroskopia (Kuva 1) mahdollistavat solujen rakenteiden ja toimintojen tarkan seuraamisen reaaliajassa.
Elävien solujen tarkka havainnointi on tärkeää, koska se auttaa ymmärtämään solutason ilmiöitä ajan kuluessa. Kuvantamismenetelmien kehittäminen on erityisen merkityksellistä lääketieteellisessä diagnostiikassa ja lääkekehityksessä: esimerkiksi syöpäsolujen liikkeiden seuraaminen voi auttaa tunnistamaan aggressiivisia solutyyppejä ja arvioimaan taudin etenemistä, kun taas proteiinien paikantaminen soluissa voi paljastaa taudinaiheuttajien toimintamekanismeja ja auttaa kohdistettujen lääkeaineiden suunnittelussa.
Elävien solujen kuvantamiseen liittyy useita haasteita. Solut ovat herkkiä ja niiden liiallinen altistaminen valolle erityisesti fluoresenssimikroskopiassa voi johtaa solujen toiminnan muutoksiin tai jopa solukuolemaan (fototoksisuus). Mikroskoopin tai itse näytteen liikkeet voivat aiheuttaa värähtelyä kuvattavaan videoon, joka puolestaan vaikeuttaa solujen seurantaa. Jotta mikroskooppikuvia voidaan mitata, täytyy niitä esikäsitellä ja analysoida tietokoneen avulla. Esikäsittelyllä tarkoitetaan kuvan laadun parantamista, kuten esimerkiksi kontrastin parantamista ja analyysissä solut tunnistetaan ja niiden ominaisuuksia, kuten muotoa tai liikkeen nopeutta, mitataan.
Syväoppiminen (deep learning) on viime vuosina tuonut merkittäviä uusia työkaluja elävien solujen kuvantamisen haasteiden ratkaisemiseksi. Syväoppiminen on koneoppimisen osa-alue, jossa neuroverkot opetetaan tunnistamaan monimutkaisia ominaisuuksia suurista tietomääristä. Elävien solujen kuvantamisessa sitä käytetään erityisesti kahdessa keskeisessä tehtävässä: kohinan poistamisessa ja solujen segmentoinnissa. Kohinanpoistomallit oppivat erottamaan aidon biologisen signaalin kuvien taustakohinasta ja mahdollistavat vähäisemmän valon käytön ja pidemmät kuvausjaksot ilman, että solut vaurioituvat. Segmentointimallit puolestaan tunnistavat ja rajaavat yksittäiset solut kuvista, mikä mahdollistaa niiden rakenteiden, muotojen ja käyttäytymisen kvantitatiivisen analyysin. Näin syväoppiminen parantaa merkittävästi kuvien laatua ja analyysin tarkkuutta, ja avaa uusia mahdollisuuksia dynaamisten biologisten ilmiöiden tutkimukseen.Tässä artikkelissa kerron, miten syväoppimista voidaan hyödyntää elävien solujen tutkimuksessa sekä miten syväoppiminen voi auttaa meitä ymmärtämään solujen maailmaa tehokkaammin ja tarkemmin kuin aikaisemmin. Keskityn erityisesti työkaluihin, jotka auttavat datan esikäsittelyssä (esim. kohinanpoisto, liikevärähtelynkorjaus, keinotekoinen leimaus) ja analyysissä (segmentointi, seuranta, aikasarja-analyysi).
Miten tutkimus tehtiin?
Tämä artikkeli pohjautuu katsausartikkeliin. Katsausartikkeli on tutkimusjulkaisu, jonka tehtävänä on arvioida ja jäsentää aiempaa kirjallisuutta sen sijaan, että se esittelisi uusia kokeellisia tuloksia. Katsauksen tavoitteena on tarjota selkeä yleiskuva tutkimuskentän nykytilasta ja kehityssuunnista.
Haimme katsausta varten tutkimuksia systemaattisesti kansainvälisistä tietokannoista hakusanoilla. Hakusanat rajasimme käsittelemään syväoppimisen sovelluksia mikroskooppikuvantamisessa vuosina 2019–2023. Lisäksi hyödynsin katsauksessa omia kokemuksiani elävien solujen kuvantamisesta, mikä tuo kirjallisuuden rinnalle käytännön näkökulman. Katsaus eroaa aiemmista aihetta käsitelleistä artikkeleista siinä, että se painottaa syväoppimisen käyttöä erityisesti elävien solujen pitkittäisseurannan apuna. Tämä aihe on toistaiseksi jäänyt vähemmälle huomiolle.
Kuvantamisella tarkoitetaan solujen tarkastelua mikroskoopin avulla ja saadun kuvan muuntamista digitaaliseen muotoon analyysiä varten. Tyypillisesti solut kuvataan joko kirkkaan valon avulla (läpivalomikroskopia) tai fluoresenssin avulla, jolloin solujen rakenteet ja prosessit voidaan nähdä erityisen tarkasti. Läpivalomikroskopia mahdollistaa solujen yleisten muotojen ja liikkeiden seuraamisen, kun taas fluoresenssimikroskopia (Kuva 1) tuo esiin yksittäisiä rakenteita, kuten proteiineja tai soluelimiä, jotka on merkitty fluoresoivilla väriaineilla. Solut siirretään lasipohjaisiin näytemaljoihin ja asetetaan mikroskoopille, jossa valo pääsee läpäisemään näytteen ja sitä voidaan tarkastella objektiivin tai tietokoneen kautta. Saatu digitaalinen kuva prosessoidaan ja analysoidaan tutkimuskysymyksen mukaan. Näin voidaan esimerkiksi seurata, miten solun tuma jakautuu solusyklin aikana.
Mitä tutkimuksessa löydettiin?
Tässä katsauksessa on nostettu esiin esikäsittelyn, segmentoinnin, seurannan ja itseohjautuvan mikroskopian osa-alueet, sillä ne ovat toistuneet keskeisinä teemoina sekä omassa tutkimustyössäni että viime vuosien kirjallisuudessa. Ne muodostuivat katsauksen päähavainnoiksi sekä omien käytännön haasteideni että kirjallisuuden yleisimpien ja lupaavimpien menetelmien perusteella.
Elävien solujen kuvantamisessa yksi keskeisimmistä haasteista on riittämätön kuvanlaatu, joka ilmenee usein liikevärähtelynä tai kohinana eli kuvan häiriönä tai vääristymänä. Liikevärähtely on merkittävä kuvanlaadun ongelma, joka voi johtua esimerkiksi mekaanisesta mikroskoopin värinästä kuvantamisen aikana. Tätä voidaan korjata erityisillä rekisteröintimenetelmillä, kuten aikaisemmin kehittämälläni Fast4DReg-ohjelmalla 1 (Kuva 2A). Fast4DReg mittaa liikevärähtelyä mikroskooppivideon aikapisteiden välillä ja suorittaa aikapisteiden välisen korjauksen tämän mittauksen perusteella. Tämän ansiosta voidaan tarkemmin seurata solujen luonnollisia liikkeitä ilman vääristymiä.
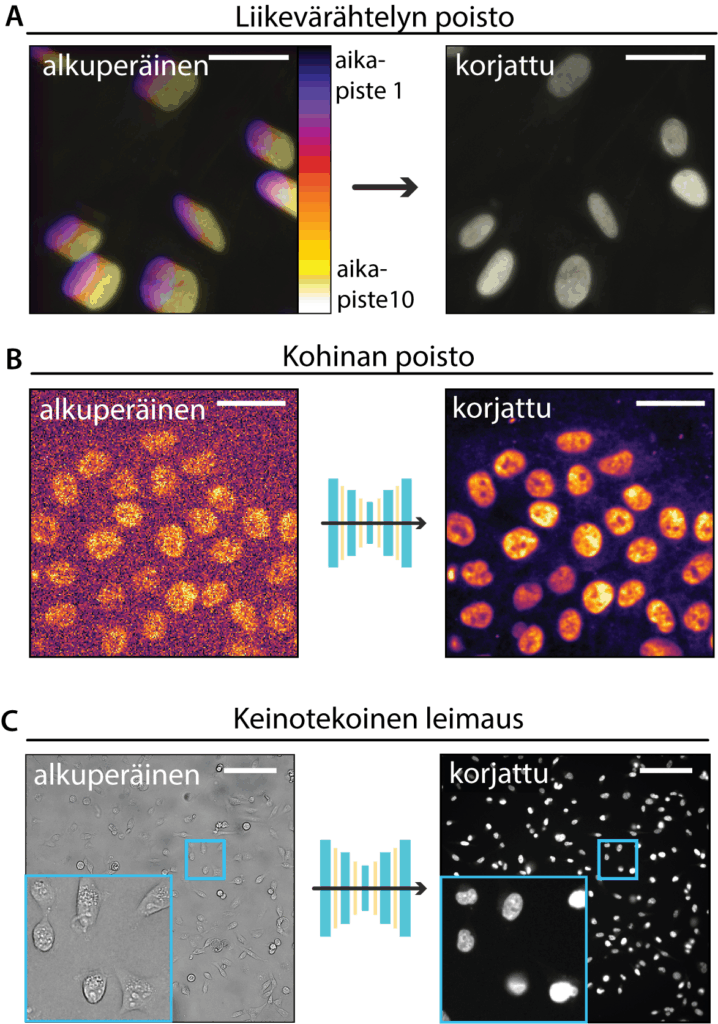
Kohina syntyy yleensä siitä, että solut ovat hyvin herkkiä valolle ja tästä syystä niitä kuvantaessa, erityisesti fluoresenssimikroskopiassa, on käytettävä mahdollisimman vähän valoa. Tämä puolestaan heikentää kuvanlaatua, kuvien kontrasti voi olla matala ja soluja voi olla vaikea tunnistaa. Viime vuosina syväoppimiseen perustuvat menetelmät ovat tarjonneet tehokkaita ratkaisuja tähän ongelmaan. Kohinaa poistavat syväoppimismallit (Kuva 2B) kykenevät poistamaan kuvista kohinaa samalla säilyttäen alkuperäisen biologisen signaalin. Näiden menetelmien ansiosta kuvantamiseen voidaan käyttää entistä vähemmän valoa, mikä vähentää soluihin kohdistuvaa rasitusta ja mahdollistaa pidemmät kuvausjaksot. Lisäksi kuvanlaadun ja informaation määrää voidaan parantaa niin kutsutulla keinotekoisella leimauksella (artificial labeling, Kuva 2C). Tällöin esimerkiksi solujen tumat voidaan ennustaa valomikroskooppikuvista ilman varsinaista fluoresenssileimausta. Soluja voidaan siis kuvata ilman fototoksista fluoresenssivaloa ja näin soluihin kohdistuvaa valon aiheuttamaa vahinkoa voidaan vähentää ja lisäksi nopeuttaa kuvantamisprosessia.
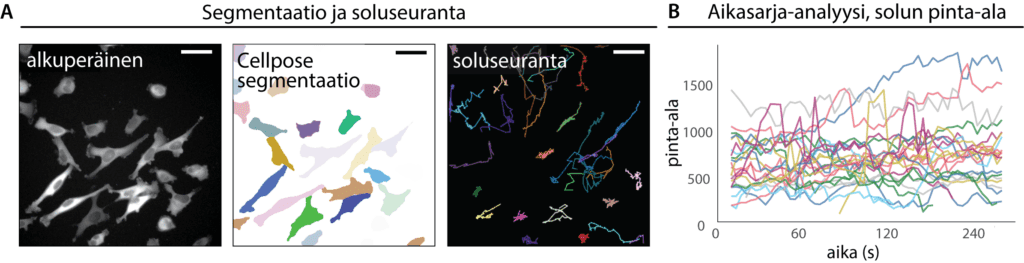
Solujen tunnistaminen eli segmentointi on keskeinen osa mikroskooppikuvien analyysiä. Segmentoinnissa solut tunnistetaan taustasta, jotta niiden muotoa, signaalia tai liikettä voidaan mitata. Syväoppimismallit, kuten StarDist2 tumien tunnistukseen ja Cellpose3 sytoplasman tunnistukseen (Kuva 3A), ovat osoittautuneet erittäin tehokkaiksi solujen segmentoinnissa erilaisilla kuvantamismenetelmillä tuotetuista kuvista.
Näiden mallien käyttö parantaa segmentoinnin tarkkuutta ja tehostaa suurten kuvamäärien käsittelyä sekä analyysin toistettavuutta. Tämä tekee niistä merkityksellisiä työkaluja etenkin suuria datamääriä käsittelevissä biologisissa tutkimuksissa, joissa tarvitaan tarkkaa ja luotettavaa tietoa solujen käyttäytymisestä.
Solujen seuranta (Kuva 3A) on keskeinen vaihe mikroskooppikuvien analyysiä. Seurannan avulla voidaan tutkia esimerkiksi solujen liikkeen suuntaa tai nopeutta. TrackMate-ohjelmisto4 mahdollistaa segmentoinnin ja seurannan yhdistämisen sekä esimerkiksi yksittäisten solujen morfologian tai signaalimuutosten seuraamisen ajan kuluessa. Tämä auttaa ymmärtämään esimerkiksi erilaisten proteiinien ilmenemistä migraation aikana.
Aikasarja-analyysi (Kuva 3B) on keskeinen osa elävien solujen tutkimusta, sillä se mahdollistaa dynaamisten prosessien, kuten liikkeen, muodonmuutosten tai fluoresenssisignaalien muutosten seuraamisen ajan suhteen. Tällainen analyysi vaatii usein useita esikäsittelyvaiheita, kuten tiedon normalisointia, ryhmittelyä ja visualisointia, jotta signaalista voidaan erottaa biologisesti merkityksellisiä kehityssuuntia. Yksi käytännöllinen ja käyttäjäystävällinen työkalu tähän tarkoitukseen on CellTracksColab5, joka on suunniteltu erityisesti soluseuranta-datan käsittelyyn. Työkalu mahdollistaa seuranta-datan helpon lataamisen, esikäsittelyn ja tulosten visualisoinnin suoraan selaimessa. CellTracksColab sopii hyvin erityisesti suurten datamäärien käsittelyyn ja tarjoaa tehokkaan tavan verrata esimerkiksi eri koeolosuhteissa olevien solujen vasteita.
Itseohjautuva mikroskopia6 on nopeasti kehittyvä ja kiehtova tulevaisuuden suunta, jossa tekoäly ei ole vain apuväline kuvien esikäsittelyssä ja analyysissä, vaan aktiivinen osa itse kuvantamisprosessia. Tässä lähestymistavassa syväoppimismallit ohjaavat mikroskooppia automaattisesti, reagoiden reaaliajassa biologisiin tapahtumiin. Tämä tarkoittaa, että mikroskooppi voi esimerkiksi vaihtaa suurennosta, tarkentaa uudelleen, muuttaa valotuksen määrää tai siirtyä seuraamaan kiinnostavaa solua tai tapahtumaa automaattisesti ja ilman käyttäjän väliintuloa.
Tällainen dynaaminen ohjaus mahdollistaa monia etuja perinteiseen mikroskopiaan verrattuna. Kuvantamisesta tulee soluystävällisempää, koska korkea resoluutio eli kuvan tarkkuus ja pitkä valotusaika aktivoituvat vain biologisesti merkityksellisissä tilanteissa, kuten esimerkiksi solunjakautumisen yhteydessä. Tämä vähentää tarpeetonta altistusta valolle ja vähentää fototoksisuutta. Samalla se parantaa mahdollisuuksia harvinaisten tai lyhytkestoisten tapahtumien kuvantamiseen, jotka saattaisivat muuten jäädä huomaamatta perinteisillä, ennalta määritellyillä kuvausasetuksilla.
Lopuksi
Syväoppiminen tarjoaa ennennäkemättömiä mahdollisuuksia elävien solujen kuvantamiseen. Sen avulla voidaan parantaa mikroskooppivideoiden kuvanlaatua, mahdollistaa pitkäkestoista kuvantamista sekä tehostaa solujen tunnistamista ja seurantaa. Lisäksi itseohjautuvat mikroskoopit vievät kuvantamisen uudelle tasolle, jossa tekoäly toimii aktiivisesti osana kokeellista tutkimusta. Näin tekoäly mahdollistaa solujen tarkemman havainnoinnin ja niiden käyttäytymisen syvällisemmän ymmärtämisen ilman, että soluja vahingoitetaan.